蛋白质类药物在癌症治疗中发挥着愈加重要的作用。然而蛋白质类药物具有特定的缺陷,如不具有肿瘤选择性,在细胞和组织内的渗透性差,有较大的副作用等,限制了其在癌症治疗中的应用。如何对蛋白质类药物进行修饰以解决以上问题,是当前癌症治疗领域的重要研究方向。
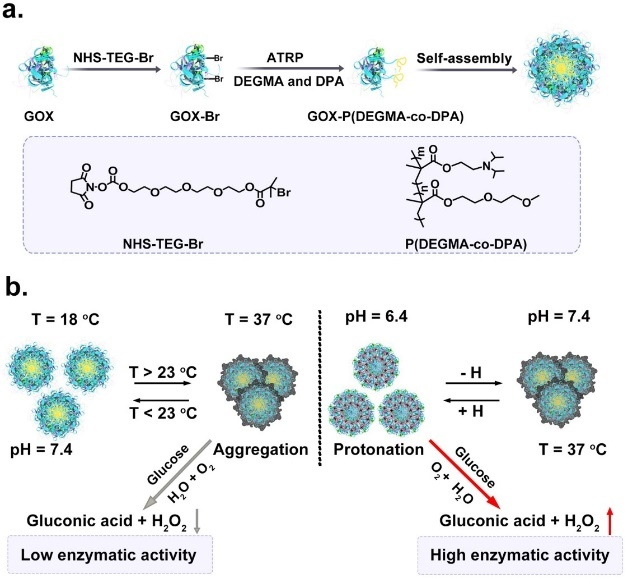
图1. GOX-P(DEGMA-co-DPA)的合成、自组装为纳米颗粒(a),及对温度和pH值的响应(b)。
论文下载链接:
https://doi.org/10.1002/adma.202209765
该工作是团队近期关于抗癌药物修饰及药物递送方向的最新进展之一。高卫平教授团队致力于蛋白质类抗癌药物的高聚物或多肽修饰,以提高药物疗效,降低副作用,促进药物在临床上的应用。在过去的两年中,团队已取得一系列开创性成果,如创新性地提出了蛋白质药物的定点原位聚合方法(JACS 2023, 145, 3, 1707–1713;Biomacromolecules 2022, 23, 11, 4834–4840;Nano Lett. 2022, 22, 20, 8294–8303,ACS Appl. Mater. Interfaces 2022, 14, 29, 32823–32835;ACS Appl. Mater. Interfaces 2021, 13, 1, 88–96),解决了传统的聚乙二醇(PEG)化修饰存在的非定点偶联、偶联效率低的问题,并且通过对肿瘤微环境的响应,极大提高了药物的肿瘤渗透性;发展了类弹性蛋白多肽(ELP)的融合方法,合成的蛋白质药物-多肽偶联物(Biomaterials 2021,264, 120447)达到1个月的蛋白质零级释放与肿瘤微环境响应性释放(Adv. Sci. 2019, 1900586),显著延长了循环半衰期。