2023年10月13日,北京大学基础医学院、北京大学国际癌症研究院张宏权/战军研究团队在Cell Death & Disease杂志上在线发表题为“Kindlin-2 in myoepithelium controls luminal progenitor commitment to alveoli in mouse mammary gland”的研究论文。这项历时5年采用了5种基因修饰小鼠的研究揭示了乳腺发育异常和泌乳功能障碍的新分子机制。
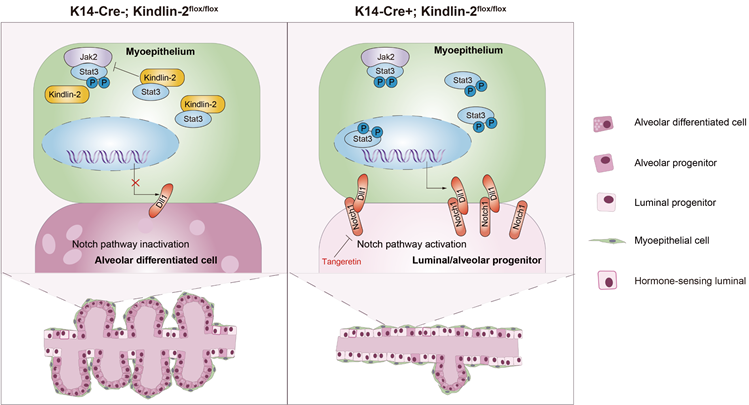
母乳喂养是婴儿的规范喂养过程,是一个公共卫生问题,不但可以提高婴儿的生存率还能增进母亲的健康。然而,全世界有5-15%的妇女患有乳腺发育异常和泌乳功能障碍。已知严格的信号通路调控是保证胚胎期和出生后正常的乳腺发育及泌乳功能的重要基础。其中乳腺干细胞中Notch1的激活对于促进管腔细胞规范化和驱动向单能雌激素受体阴性管腔祖细胞的渐进过渡至关重要。在妊娠和哺乳的最后三个月,Notch通路的激活受到抑制。但是Notch通路配体被调节的机制还不清楚。Kindlin-2(由FERMT2基因编码)这一整合素相互作用蛋白被发现在中胚层及其来源组织器官中高表达,尽管大量的研究报道Kindlin-2在肿瘤中通过蛋白质相互作用调控Wnt、Hippo、EGFR以及TGFβ等重要信号通路,但其在乳腺发育过程中的生物学功能及作用的分子机制仍是未知。该研究团队发现小鼠乳腺肌上皮中Kindlin-2缺失通过跨细胞激活乳腺腔上皮Notch信号通路,抑制管腔祖细胞向腺泡细胞分化,进而导致乳腺丧失正常泌乳功能,并发现治疗此泌乳障碍的药物-Notch信号通路抑制剂桔皮素。
该团队首先在乳腺导管腔、肌上皮分别特异性敲除Kindlin-2,肌上皮缺失Kindlin-2小鼠(K14-Cre+; Kindlin-2flox/flox)发生青春期乳腺导管树发育障碍和泌乳期腺泡发育异常以及仔鼠无法存活,而腔上皮特异性缺失Kindlin-2的小鼠(MMTV-Cre+; Kindlin-2flox/flox)能够哺育仔鼠存活。为了明确敲除Kindlin-2之后乳腺细胞组分的变化和信号调控改变,研究组对E18.5小鼠乳腺进行单细胞RNA测序,分析结果发现:肌上皮缺失Kindlin-2的孕鼠乳腺腔上皮细胞主要由腺泡祖细胞和腔祖细胞组成,几乎没有腺泡细胞发育,而腔上皮缺失Kindlin-2的孕鼠乳腺的腔上皮细胞比例与WT组无显著差异。此过程中我们补充了以往报道数据对于泌乳期腺泡分化细胞捕获缺失的不足,完善了这部分细胞的注释。进而拟时序分析结果显示肌上皮缺失Kindlin-2阻止腔上皮祖细胞分化为腺泡细胞,完美解释了肌上皮特异性缺失Kindlin-2导致的小鼠泌乳障碍。进一步CellChat分析结果提示Notch细胞通讯过度激活发生在肌上皮缺失Kindlin-2的乳腺,接下来荧光多色免疫标记技术检测肌上皮中的Dll1和腔上皮中的Notch1,进一步在组织原位证实了肌上皮缺失Kindlin-2显著激活了肌上皮与腔上皮之间的Notch信号通路。同时支持这一观点的是研究组在肌上皮特异性敲入Kindlin-2小鼠(K14-Cre+; Kindlin-2LSL/LSL)乳腺导管中检测到Notch信号通路受到显著抑制。
为了进一步揭示具体分子机制,研究组通过蛋白质相互作用检测发现肌上皮细胞中Kindlin-2结合Stat3并抑制JAK2(Stat3的磷酸激酶)与Stat3相互结合,从而导致Stat3 Y705和S727位点不能充分磷酸化。相反,Kindlin-2缺失促进Stat3的磷酸化激活并上调Stat3的下游靶分子Dll1,Dll1激活导管腔上皮细胞中的Notch通路,并在妊娠期间抑制管腔祖细胞的分化和成熟。为了确定Kindlin-2缺失是否通过平滑肌组织中的共同机制促进Stat3磷酸化和Dll1的表达,研究组采用Kindlin-2敲低(KO-First)和平滑肌特异性缺失Kindlin-2( MYH-cre+; Kindlin-2fl/fl)小鼠的平滑肌组织进行免疫组织化学染色。与此同时,利用荧光多色免疫标记技术在E18.5肌上皮缺失Kindlin-2小鼠(K14-Cre+; Kindlin-2flox/flox)乳腺检测肌上皮中的Dll1和Stat3 Y705和S727位点的磷酸化水平,在组织原位证实了Kindlin-2–Stat3–Dll1信号级联的存在。最后研究组应用桔皮素抑制Notch信号通路,使肌上皮中Kindlin-2缺失的妊娠小鼠的管腔祖细胞恢复向腺泡细胞分化的能力,并具有延长仔鼠生存期的治疗效果。
总之,该研究组揭示了Kindlin-2–Stat3–Dll1跨细胞调控乳腺发育异常和泌乳功能障碍的新分子机制。该研究在医疗卫生领域指导产后提升改善产妇哺乳能力,预防乳腺疾病以及乳制品制造业提升质量和产量中均具有重要的科学意义和潜在的转化价值。
北京大学基础医学院博士研究生王振斌、张磊、李冰、宋佳桂为本文共同第一作者,北京大学基础医学院、北京大学国际癌症研究院张宏权教授和战军副教授以及昆明医科大学生物医学工程研究院、中国科学院昆明动物研究所陈策实教授为论文的通讯作者。该研究受国家重点研发计划项目、国家自然科学基金项目、云南省基础研究项目、北京市自然科学基金项目以及北京大学基金的资助。
原文链接:https://www.nature.com/articles/s41419-023-06184-2.p