北京大学高卫平团队《Adv. Sci.》:“热响应多肽融合门冬酰胺酶在治疗血液肿瘤中表现出减轻的免疫原性和增强的疗效”的研究
发布日期:2023-06-12 | 点击量:
血液肿瘤起源于造血系统,发病快、预后差、五年生存期短,是严重影响人类健康的恶性疾病。骨髓移植是治疗血液恶性肿瘤最有效的方法,但骨髓移植会受到患者经济条件、是否有合适的供者、移植相关并发症等因素限制。化疗药物虽然可以有效地杀死肿瘤细胞,从而为骨髓移植和个性化靶向治疗争取时间,但化疗药物往往不能区分肿瘤细胞和正常细胞,不可避免地杀死体内正常细胞,从而诱发严重的毒副作用。近年来,靶向治疗和免疫疗法极大地改变了血液肿瘤的治疗现状,因此,血液肿瘤的药物研发已经从具有显著毒副作用的化疗转向靶向治疗和免疫治疗。然而,受到脱靶效应、抗原逃逸、免疫相关的不良事件和免疫治疗耐药性的等问题的影响,靶向治疗和免疫治疗也面临了巨大的挑战。
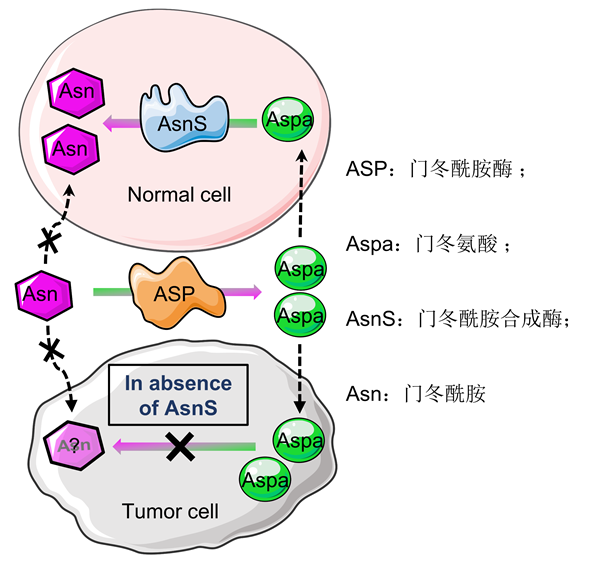
门冬酰胺酶(L-Asparaginase,ASP)是一种将门冬酰胺(Asn)水解成门冬氨酸和氨气的酶,ASP可以减少肿瘤细胞对营养物质Asn的摄取,从而根除对外源Asn有高需求的肿瘤细胞(图 1)。淋巴母细胞尤其是白血病细胞缺乏门冬酰胺合成酶(AsnS)的表达,只能依赖于外源Asn的摄取来维持自身的基本生命活动,基于这一机制,ASP是治疗血液肿瘤的基础药物。然而,由于ASP的免疫原性高、毒性大、半衰期短、稳定性差,通常需要多次大剂量给药才能获得足够的疗效,这就不可避免地诱发了严重的副作用,如超敏反应、胰腺炎、肝脂肪变性、肝硬化和凝血功能障碍等,因而限制了最佳的临床使用并经常导致治疗中断。
聚乙二醇化门冬酰胺酶(Pegaspargase,PEG-ASP),商业上被命名为Oncaspar®,已被证明是应对这些问题的有效策略。2006年,PEG-ASP被美国FDA批准为急性淋巴细胞白血病(ALL)的一线治疗,美国国家综合癌症网络肿瘤学临床实践指南2021.1版进一步推荐用PEG-ASP来替代ASP治疗小儿ALL。PEG-ASP的聚乙二醇(PEG)链不仅可以在一定程度上覆盖ASP的免疫原性位点从而降低ASP的免疫原性,而且能够增加药物的循环半衰期。然而,最近的研究发现,由于PEG在食品、化妆品和药品中的广泛应用,人体中普遍存在抗PEG抗体,这可能导致PEG修饰的药物会在体内出现加速血液药物清除(ABC)现象、诱发严重的超敏反应以及降低其临床疗效等诸多问题。
为了解决ASP和PEG-ASP面临的问题,近期,北京大学
高卫平团队
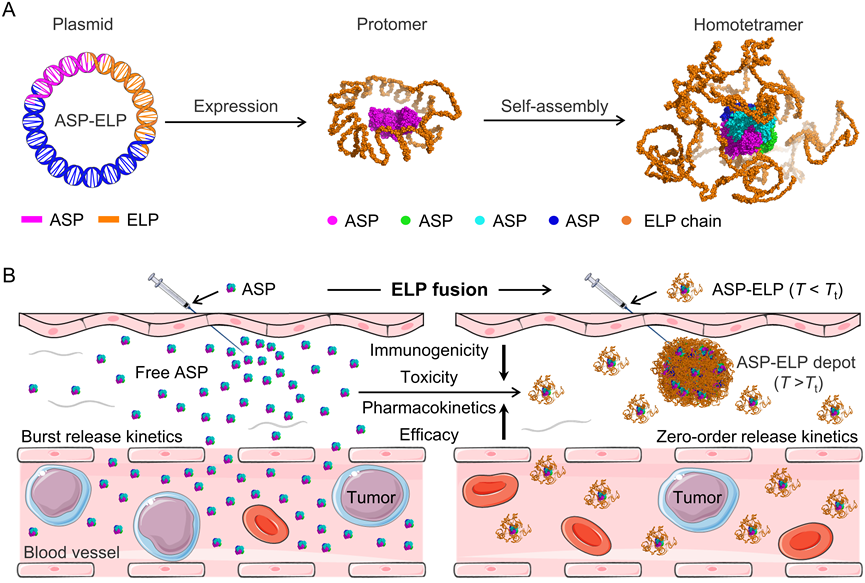
提出了一种弹性蛋白样多肽 (ELP)融合ASP(ASP-ELP)作为更有前途的血液肿瘤治疗药物。
ASP-ELP独特的热敏性能够在注射后原位形成具有长期零级释放动力学的药物储库,与ASP和PEG-ASP相比,ASP-ELP具有增加的活性保留率、改善的稳定性、延长的半衰期、减轻的免疫原性、降低的毒性和增强的疗效。相关工作以“Thermoresponsive Polypeptide Fused L-Asparaginase with Mitigated Immunogenicity and Enhanced Efficacy in Treating Hematologic Malignancies”为题发表在Advanced Science。

该研究介绍了一种能够降低免疫原性、减轻系统性毒性、增强循环半衰期和增强抗肿瘤功效的新型的类弹性蛋白融合门冬酰胺酶(ASP-ELP)及其制备方法与应用。该研究提出采用AlphaFold 2对ASP-ELPs候选分子进行结构预测,基于降低免疫原性和保留生物活性的考虑筛选出两种ASP-ELPs候选分子(ASP-ELP60和ASP-ELP90),并证明了所设计的ASP-ELPs相比原药(ASP)和长效的聚乙二醇化门冬酰胺酶(PEG-ASP)具有多种优势。体内外的实验结果显示,ASP-ELP90在酶活性保留率、储存稳定性、药物代谢动力学、免疫原性、生物安全性、抗血液肿瘤疗效等方面均展现出优越性。值得注意的是,ASP-ELP90的温敏特性能够使它在体内形成药物储库,从而实现长效零级缓释。该研究的研究不仅为基于人工智能辅助设计蛋白质-高分子偶联物的药物研发提供一种新的设计方法,同时也筛选出一种具有巨大转化潜力的治疗血液恶性肿瘤的药物ASP-ELP90(图2)。
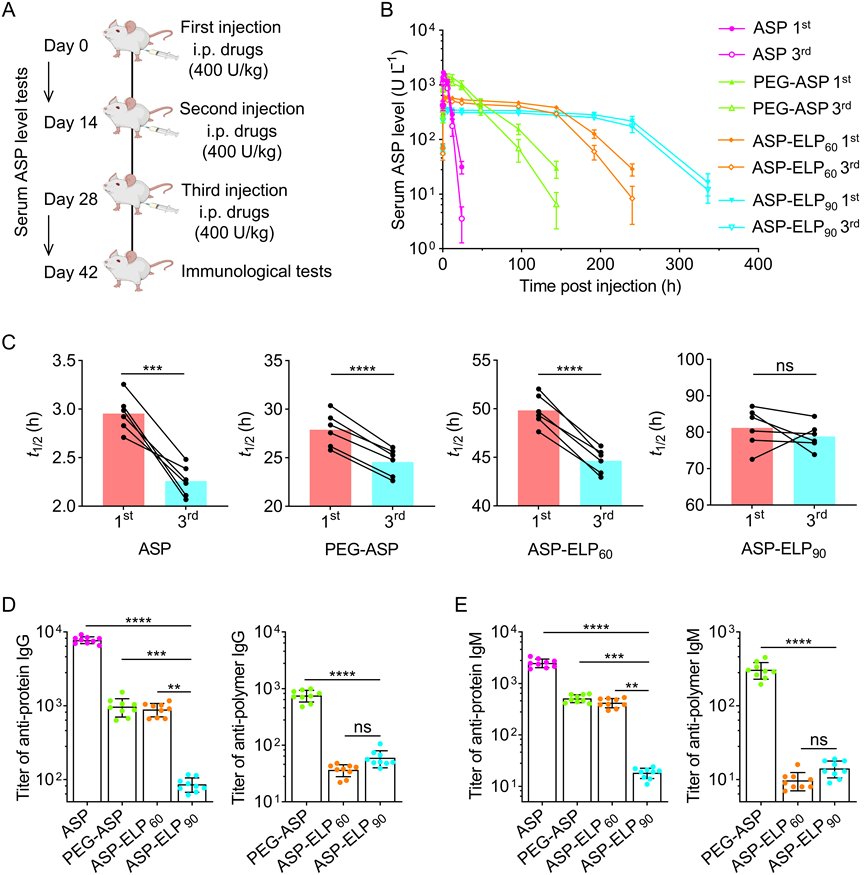
根据AlphaFold 2预测的ASP、ASP-ELP60和ASP-ELP90的结构,本研究推测ASP-ELPs通过包裹ASP表面的免疫原性位点来降低ASP的免疫原性,包裹更加充分的ASP-ELP90的免疫原性会比ASP-ELP60低,二者的免疫原性均会显著低于完全无包裹的ASP。为了验证本研究的假设,本研究对三轮药物注射后BALB/c小鼠的免疫前后各项指标的变化进行了分析。本研究发现,与第一次注射后相比,第三次注射后ASP、PEG-ASP和ASP-ELP60组小鼠的血清ASP活性水平明显降低,这可能是ASP、PEG-ASP和ASP-ELP60的免疫原性诱发了小鼠体内加速药物清除(ABC)效应,与ASP、PEG-ASP和ASP-ELP60组相比,ASP-ELP90组的ASP活性水平变化并不明显,这意味ASP-ELP90免疫原性可能最低。为了进一步证明上述结论,本研究测量了接受药物注射后的小鼠血清中的抗体浓度。注射ASP-ELP60、PEG-ASP和ASP后,血清中的抗蛋白免疫球蛋白G(IgG)/免疫球蛋白M(IgM)滴度分别比ASP-ELP90高10-/23-、11-/28-和90-/137-倍,证实ASP-ELP90中ASP的免疫原性明显更低。本研究还测量了抗聚合物的IgG/IgM滴度以进一步阐释本研究的发现。PEG-ASP抗PEG聚合物的IgG/IgM滴度分别是ASP-ELP60抗ELP60和ASP-ELP90抗ELP90的21-/31-和13-/22-倍,表明ELP的免疫原性远远低于PEG。此外,针对ELP的IgG/IgM滴度在ASP-ELP90组和ASP-ELP60组之间没有明显差异,表明ELP的免疫原性与ELP链长无关。
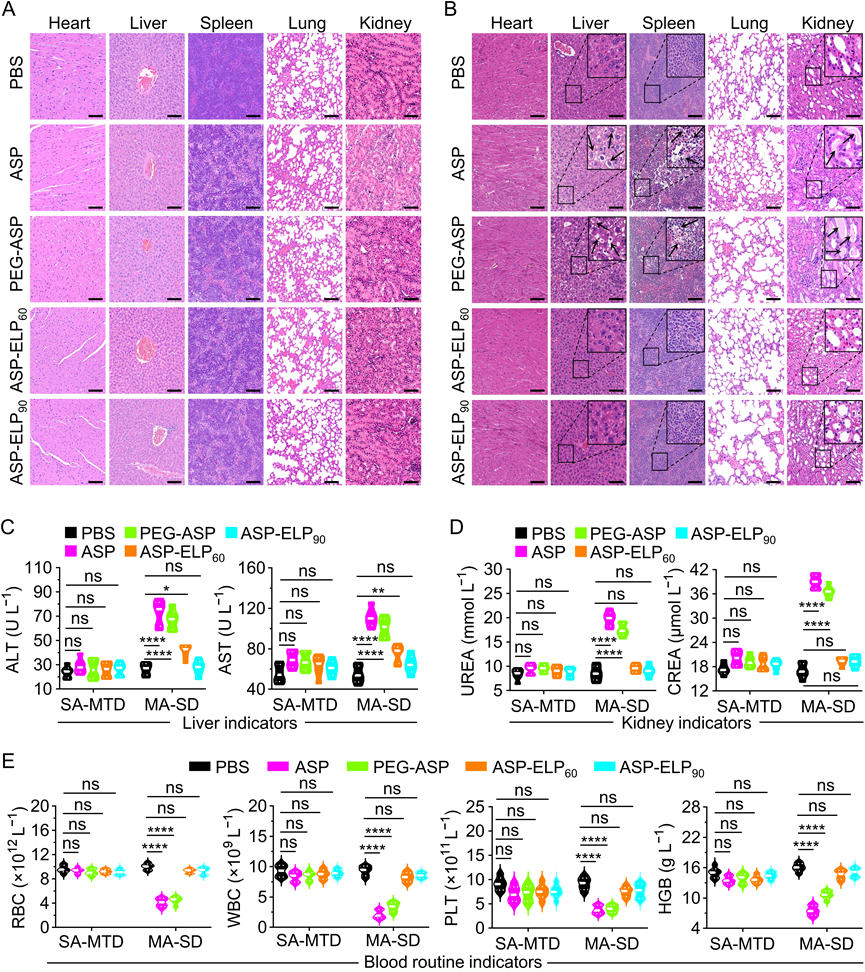
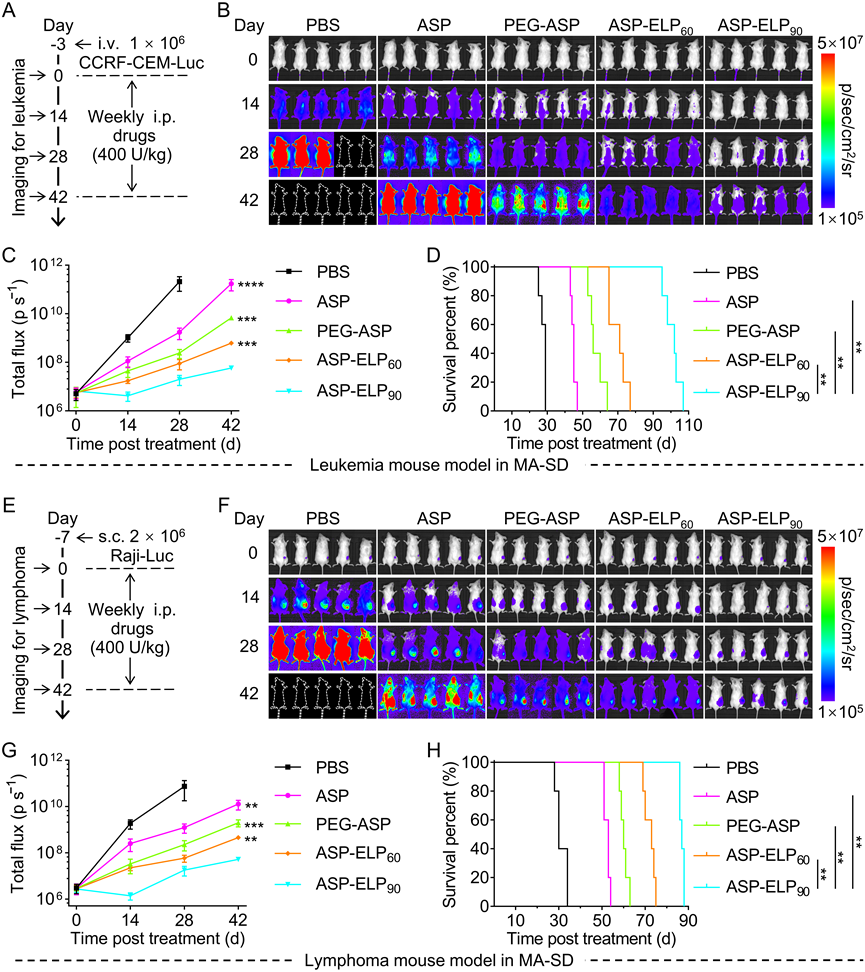
该研究在体内毒性研究中评估了两种给药方案:单次给药最大耐受剂量(SA-MTD)和多次给予相同剂量(MA-SD)(图4)。对于SA-MTD的毒性评估,与PBS组相比,所有治疗组都没有发现明显的组织病理学改变,也没有发现异常的血液学指标。然而,对于MA-SD的毒性评估,本研究在ASP和PEG-ASP组的肝脏、脾脏和肾脏H&E染色的病理切片中观察到明显的组织学病变。具体而言,肝脏组织中可见由于肝细胞变性而产生的脂质空泡(黑色箭头),脾脏组织中可见肿胀、变性和坏死的脾细胞(黑色箭头),肾脏组织中可见均匀的红染蛋白沉积和脱落坏死的肾小管上皮细胞(黑色箭头)。与组织病理学结果一致,ASP组和PEG-ASP组的几个血生化参数显示异常,包括肝脏指标天冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT),肾脏指标肌酐(CREA)和血尿素氮(BUN),以血液常规指标红细胞(RBCs)、白细胞(WBCs)、血小板(PLTs)和血红蛋白(HGB)。本研究将ASP和PEG-ASP组的毒副作用归因于六次注射后高免疫原性的ASP和PEG-ASP诱发的免疫相关毒性,以及每次注射后高峰值浓度诱发的剂量相关毒性。ASP-ELP60组和ASP-ELP90组没有明显的组织学异常,血液学指标也没有统计学上的显著差异,只是ASP-ELP60组的ALT和AST明显升高,说明与ASP-ELP60相比,ASP-ELP90的体内安全性更高,可以被其低免疫原性和低峰值浓度所解释。总之,ASP-ELPs,尤其是ASP-ELP90在降低全身毒副作用发生率方面表现突出。
为了评估ASP、PEG-ASP、ASP-ELP60和ASP-ELP90的抗肿瘤疗效,本研究分别在白血病和淋巴瘤小鼠模型的细胞系移植(CDX)模型中评估了SA-MTD和MA-SD两种治疗方案(图5和图6)。对于白血病小鼠模型,在SA-MTD治疗方案下,ASP-ELP90组的体内白血病增殖明显慢于ASP、PEG-ASP和ASP-ELP60组。在采用SA-MTD治疗的淋巴瘤小鼠模型中也观察到与白血病小鼠的治疗类似的结果(图5)。尽管是单次给药,ASP-ELP90比ASP、PEG-ASP和ASP-ELP60更明显地延长了癌症缓解期。
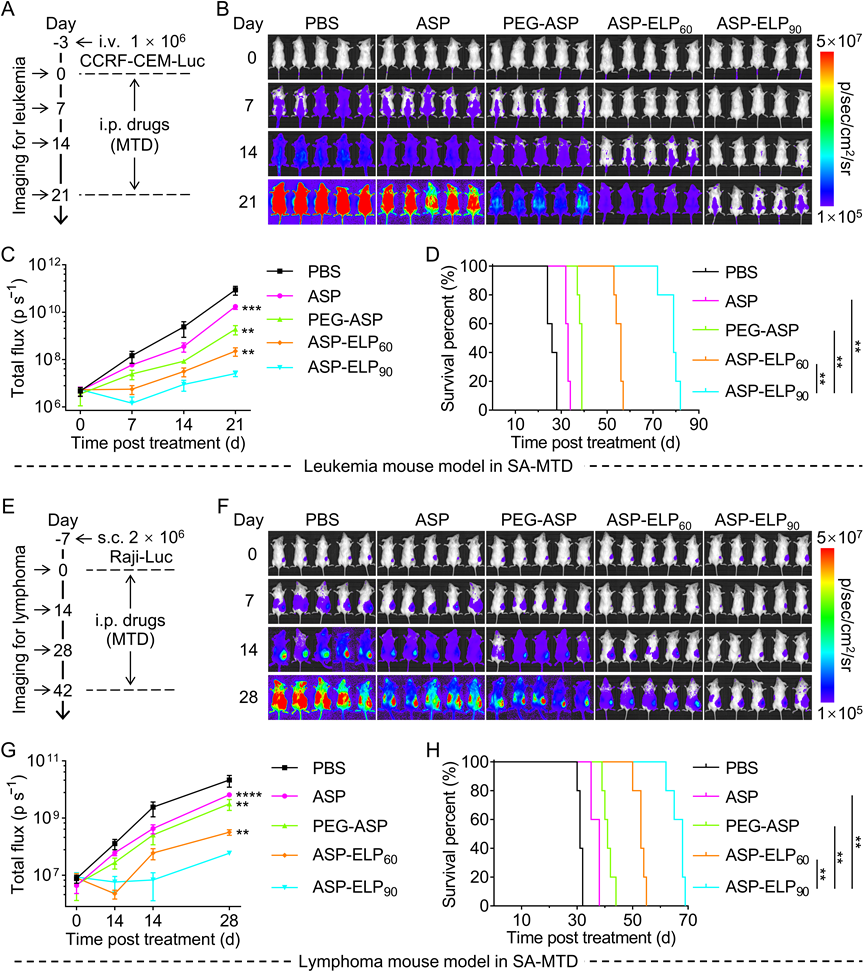
该研究进一步评估了MA-SD治疗方案下,不同药物的抗白血病疗效。与SA-MTD治疗效果类似,ASP-ELP90组也比ASP-ELP60、ASP-PEG和ASP组显示出更强的抗肿瘤疗效(图6)。在相同的给药方案下,ASP-ELP90治疗血液肿瘤癌症的效果明显优于ASP、PEG-ASP和ASP-ELP60。最后,该研究验证了MA-SD给药时,ASP、PEG-ASP、ASP-ELP60和ASP-ELP90抗淋巴瘤的疗效,该研究发现
ASP-ELP90组依然比ASP-ELP60、ASP-PEG和ASP组表现出更强的抗肿瘤疗效和明显更长的生存时间(图6)。药效结果表明,两种给药方案下,ASP-ELP90治疗血液癌症的效果都明显优于ASP、PEG-ASP和ASP-ELP60,更加有利的说明了ASP-ELP90是一种有效的治疗剂,作为ASP和PEG-ASP的替代品在治疗血液系统恶性肿瘤方面有巨大的优势。
该研究表明,所设计的ASP-ELPs比ASP和PEG-ASP具有多种优势。体外和体内的结果显示,ASP-ELPs在生物安全性和抗血液肿瘤效果方面优于PEG-ASP。该研究将ASP和PEG-ASP组的毒性反应归结为多次注射后ASP和PEG-ASP的高免疫原性引起的免疫相关毒性和每次注射后的峰值浓度引起的剂量相关毒性。由于ASP-ELPs的免疫原性和峰值浓度较低,其体内安全性更高。温敏缓释的ASP-ELPs形成的体内药物储库使其半衰期明显长于ASP和PEG-ASP,因而治疗周期也明显延长,相应的治疗效果得到显著改善。此外,无论是单次最大耐受剂量给药,还是多次相同剂量的给药,ASP-ELP90治疗血液肿瘤的效果明显优于ASP、PEG-ASP和ASP-ELP60,揭示了ASP-ELP90作为这两种药物替代品治疗血液肿瘤的前景。总之,该研究充分证明了ASP-ELP90具有免疫原性和毒性低、药代动力学特性改善、抗血液肿瘤疗效增强等优点,也说明了ASP-ELP90是一种新的治疗血液肿瘤有效疗法。
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202300469






