2024年7月4日,北京大学基础医学院、北京大学国际癌症研究院的张宏权教授/战军研究员领导的研究团队在Science Advances杂志上在线全文发表了题为“Tumor Suppressor FRMD3 Controls Mammary Epithelial Cell Fate Determination via Notch Signaling Pathway” 的研究论文。这项历时6年的研究采用了2种基因修饰小鼠模型结合乳腺癌患者样本的分析,发现抑癌蛋白FRMD3基因失活的小鼠乳腺上皮细胞中发生“腔上皮转分化为基底上皮”的细胞谱系可塑性改变,其结果导致自发性三阴性乳腺癌的产生。
长期以来乳腺上皮细胞在发育过程和乳腺癌发生发展过程中的谱系可塑性调控,一直是困扰乳腺癌发生机制的阐释和精准治疗方案选择中的难点问题。研究工作揭示出FRMD3基因失活通过激活乳腺上皮细胞中的Notch信号通路,促进乳腺干细胞亚群扩增并抑制乳腺腔上皮谱系的发育,同时FRMD3基因的失活也导致乳腺癌细胞干性的增强。这项研究为乳腺发育提供了新的机制解析,也为三阴乳腺癌的药物干预提供了新的潜在靶点。

Notch信号通路在发育和肿瘤发生发展中起到关键调控作用。Notch信号通路参与乳腺干细胞的维持、细胞命运的决定以及乳腺发育和成熟过程中的分化。团队前期研究表明,乳腺干细胞中Notch1的激活对于促进管腔细胞规范化和驱动向单能雌激素受体阴性管腔祖细胞的渐进过渡至关重要。乳腺上皮细胞(MECs)从管腔上皮到基底上皮特性的转变伴随着乳腺上皮细胞谱系可塑性的变化,然而,其分子机制尚不清楚。在这项研究工作中,研究人员发现Frmd3基因的失活抑制了乳腺(MG)谱系的发育并诱导了MEC的干性,随后导致了自发性三阴乳腺癌(TNBC)的发生。在PyMT小鼠中Frmd3在乳腺腔上皮中的特异性缺失导致小鼠乳腺管腔上皮向基底细胞转分化的增加及乳腺癌细胞干性的增强。对MECs的单细胞RNA测序分析表明,敲除Frmd3基因显著地抑制了乳腺上皮祖细胞向腔上皮细胞的分化。伴随着这个亚群细胞,Notch信号通路被明显抑制。
在机制的阐释上,研究人员发现FRMD3通过结合并抑制Disheveled-2与E3泛素连接酶UPS9x之间的相互作用来稳定Disheveled-2。FRMD3也抑制Disheveled-2和激酶CK1之间的相互作用,进而抑制Disheveled-2的磷酸化;FRMD3通过抑制Disheveled-2与入核辅助蛋白FOXK1/2之间的相互作用来抑制Dishevled-2核转位;FRMD3通过抑制Disheveled-2与Notch细胞内结构域NICD之间的相互作用,从而解除Disheveled-2对Notch信号通路的限制作用。综合起来,FRMD3激活Notch信号通路,而Notch信号通路的激活又可促进乳腺上皮细胞向腔系的分化。在临床相关性上,对90例乳腺癌患者标本中FRMD3蛋白水平的测定,结果表明三阴性乳腺癌组织中FRMD水平更低,而低水平的FRMD3预示临床乳腺癌患者的不良预后。究其水平降低的原因,研究人员发现FRMD3在乳腺癌中低表达是由于FRMD3启动因子高甲基化的所致,DNA甲基转移酶的抑制剂可以很大程度上逆转FRMD3的表达水平,从而为稳定FRMD3在细胞中的水平,抑制三阴乳腺癌的发生发展提供了可能。
北京大学基础医学院博士研究生马集 (已毕业)、硕士研究生龚玉清(已毕业)、博士研究生孙小然(已毕业)为本文的第一作者,北京大学基础医学院、北京大学国际癌症研究院张宏权教授和战军研究员,昆明医科大学生物医学工程研究院、中国科学院昆明动物研究所陈策实教授,中国医学科学院及国家癌症中心马飞教授为论文的通讯作者。这项研究受国家重点研发计划项目、国家自然科学重点项目及面上项目、云南省基础研究项目、北京市自然科学基金项目以及北京大学重点基础研究专项、北京大学“双一流”肿瘤精准医学学科建设项目、临床医学+X项目及教育部癌症整合组学前沿科学中心基金的资助。
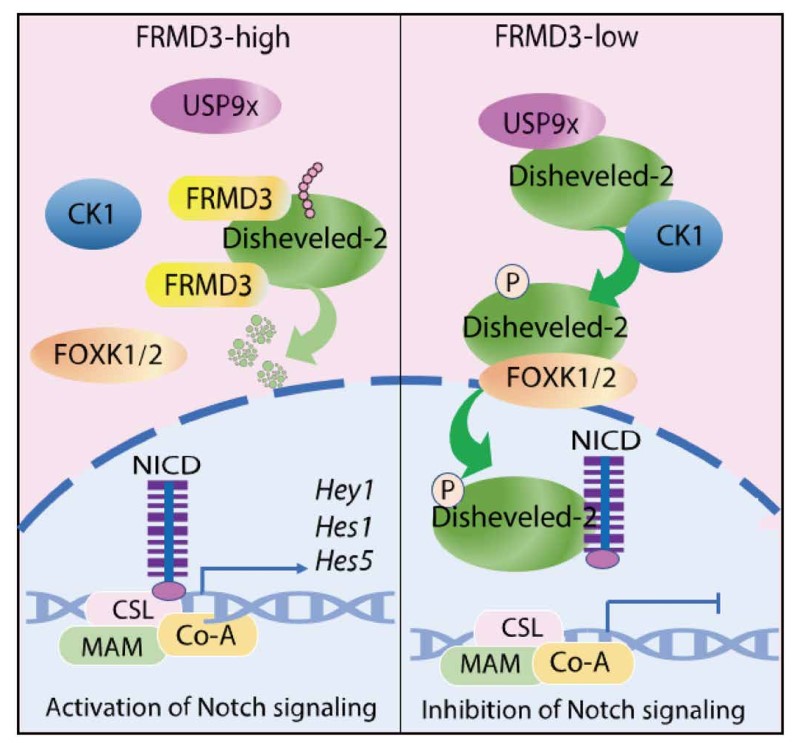
工作模型:
抑癌蛋白FRMD3促进Dishevedled-2降解并激活Notch信号通路的机制
论文链接:https://www.science.org/doi/abs/10.1126/sciadv.adk8958