胃癌是一种严重威胁人类健康且预后较差的上消化道肿瘤,我国胃癌的新发病例数约占全球新发病例数的44%,疾病负担十分严重【1】。初步证据显示,以有氧糖酵解增加为特征的代谢重编程与胃癌发生、发展的多个步骤相关。因此,更好地理解胃癌细胞如何调控内在代谢,来达到代谢模式与肿瘤发展不同阶段对能量与代谢中间产物需求的相协调,有望为胃癌治疗新策略的开发提供线索。
2022年9月26日,北京大学肿瘤医院、北京大学国际癌症研究院吴健民研究员团队、季加孚教授团队等合作在PNAS在线发表题为Dual roles of β-arrestin 1 in mediating cell metabolism and proliferation in gastric cancer 的研究论文。该研究通过临床队列、细胞功能和分子机制的综合分析,揭示了 β-arrestin 1 (ARRB1) 与PKM2蛋白结合调控胃癌细胞代谢重编程的新机制,并发现对ARRB1-PKM2调控轴进行干预可有效抑制胃癌细胞的增殖。

研究人员首先通过胃癌临床队列研究发现ARRB1 在肿瘤组织中的表达水平显著高于正常组织,并且ARRB1的高表达与胃癌患者的不良预后呈显著正相关。研究人员进一步利用患者来源的胃癌类器官模型进行功能研究,发现降低ARRB1表达可显著抑制胃癌类器官的增殖能力。根据生物信息分析提供的线索,研究人员接着利用Seahorse XF技术分析了 ARRB1 对胃癌细胞代谢功能的影响,发现ARRB1表达的降低可导致胃癌类器官的糖酵解能力显著下降;并得到靶向代谢组学实验结果的进一步验证,其中磷酸戊糖途径的代谢产物下调尤为显著。这些结果表明ARRB1 可调控胃癌细胞的代谢重编程,以提供更多中间产物用于生物合成,来支持肿瘤细胞增殖的需求。
ARRB1因对GPCR(G蛋白偶联受体)信号通路的负性调控而知名。国内外近年研究表明,ARRB1 还有着独立的、作为多功能支架蛋白的作用【2】,并在不同组织来源的肿瘤中发挥了特异的功能,这些组织特异性的功能主要依赖于其结合的互作蛋白。为探明ARRB1介导胃癌代谢重编程的具体机制,研究人员通过免疫共沉淀偶联质谱分析发现多个ARRB1的互作蛋白,其中M2型丙酮酸激酶(PKM2)引起了研究人员的注意。PKM2在肿瘤葡萄糖代谢途径中发挥关键“阀门”作用,其丙酮酸激酶活性调控着肿瘤细胞进行合成代谢或分解代谢的流向。研究人员通过coIP-WB、蛋白互作ELISA、邻位连接技术PLA等多重手段验证了ARRB1和PKM2的互作关系,并发现敲降ARRB1可显著恢复PKM2的激酶活性。
接着,研究人员通过排阻色谱等实验发现ARRB1 与 PKM2 的结合抑制了具有高酶活的PKM2 四聚体的形成,细胞内的PKM2 蛋白更多的维持在二聚体及单体状态,从而显著降低了 PKM2 激酶活性。并构建了ARRB1与PKM2蛋白的截断体,通过互作实验明确了ARRB1-PKM2的结合结构域,以及探索了不同结构域对PKM2活性的抑制程度。
最后,综合类器官和荷瘤小鼠模型的药敏实验,研究人员发现PKM2 激动剂DASA-58可有效解除ARRB1 对 PKM2 活性的抑制,并对肿瘤增殖有显著的抑制作用,其中ARRB1 高表达的肿瘤对 PKM2 激动剂更加敏感。
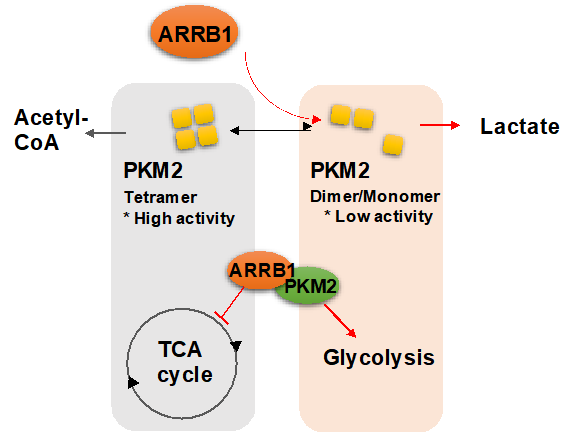
图1. ARRB1调控PKM2介导的肿瘤代谢重编程的模式图
综上所述,本研究揭示了ARRB1在肿瘤代谢重编程中的调控作用和相关机制,并提示增强PKM2激酶活性可有效抑制ARRB1高表达导致的肿瘤细胞过度增殖,为后续基于肿瘤的代谢脆弱性开发胃癌治疗新策略提供了理论依据。
吴健民课题组结合计算与实验手段,长期专注肿瘤领域的生物信息学研究和多组学数据驱动的肿瘤基础研究。课题组前期开发的癌症队列大数据分析平台CVCDAP (Nucleic Acids Res. 2020, https://omics.bjcancer.org/cvcdap/)和肿瘤蛋白互作分析平台PINA 3.0 (Nucleic Acids Res. 2021, https://omics.bjcancer.org/pina/) 在本研究的候选基因挖掘和互作蛋白发现方面也起到了关键辅助作用。课题组长期欢迎肿瘤学、生物信息学和机器学习等相关专业的博士后,与硕、博研究生的加盟。
制版人:十一
参考文献
1. L. Yang, X. Ying, S. Liu, G. Lyu, Z. Xu, X. Zhang, H. Li, Q. Li, N. Wang, J. Ji, Gastric cancer: Epidemiology, risk factors and prevention strategies. Chin J Cancer Res 32, 695-704 (2020).
2. S. Ahn, S. K. Shenoy, L. M. Luttrell, R. J. Lefkowitz, SnapShot: beta-Arrestin Functions. Cell 182, 1362-1362 e1361 (2020).
3. L. Jiang, R. J. Deberardinis, Cancer metabolism: When more is less. Nature 489, 511-512 (2012).