肿瘤细胞的快速生长消耗氧气以及异常的肿瘤血管结构限制了氧气供应。缺氧通常会导致对放疗、光动力治疗、化疗和免疫疗法的耐药性的发展,从而导致许多恶性肿瘤的临床预后不佳。为了逆转肿瘤缺氧,目前已经开发了多种策略,如使肿瘤血管正常化、通过载体向肿瘤输送氧气以及靶向缺氧诱导因子。然而,这些策略尚存在一些问题,包括缺乏肿瘤靶向性、氧气供应不足和严重的副作用,这限制了它们在临床中的进一步应用。
过氧化氢酶(CAT)在高效催化肿瘤细胞原位产生的过氧化氢(大多数固体肿瘤内的浓度为10-100 μM)方面具有潜力。然而,CAT固有的缺陷包括免疫原性、稳定性差、循环半衰期短以及肿瘤积聚和渗透性差,导致在体内逆转肿瘤缺氧的效果不佳。为了解决这些问题,已经设计了一些纳米载体,如脂质、壳聚糖和介孔二氧化硅,用于物理封装CAT;此外也应用了聚乙二醇(PEG)来化学修饰CAT。尽管CAT在这些纳米载体中的封装或PEG化可以在不同程度上增强稳定性、减少免疫原性、延长半衰期并增加肿瘤积聚,但由于这些纳米颗粒的体积庞大,不可避免地由于肿瘤组织的致密结构和高间质压力而导致肿瘤渗透性差。
近期,北京大学跨学部生物医学工程系高卫平教授和魏勋斌教授课题组合作提出了一种新颖且普适的策略,通过控制超酸敏感蛋白质-聚合物共价自组装的方式设计超酸敏感纳米胶束,以有效逆转肿瘤缺氧,增强肿瘤对光动力治疗的敏感性,有望对放疗、化疗和免疫疗法产生有益影响。为了证明该概念,作者从CAT中生长pKa约6.9的聚(乙基丙基氨乙基甲基丙烯酸酯)(PEPA)形成CAT-PEPA。由于人血清白蛋白(HSA)非常稳定且非免疫原性,它可以在血液中循环长达19天,并通过结合新生儿Fc受体选择性地积累到肿瘤中。因此,作者决定从HSA中生长PEPA形成HSA-PEPA,并将其与CAT-PEPA混合以构建HSA/CAT-PEPA纳米胶束。这些纳米胶束由于稳定性的提高、分子量增加和免疫原性的降低而能够实现体内长时间循环。由于肿瘤微环境略微酸性(细胞外pH:6.4-7.1),这些纳米胶束可解离为带正电的单体,吸附在肿瘤细胞表面上以触发CAT-PEPA的转运,从而导致增强的肿瘤渗透性,实现有效的缺氧逆转(图1)。
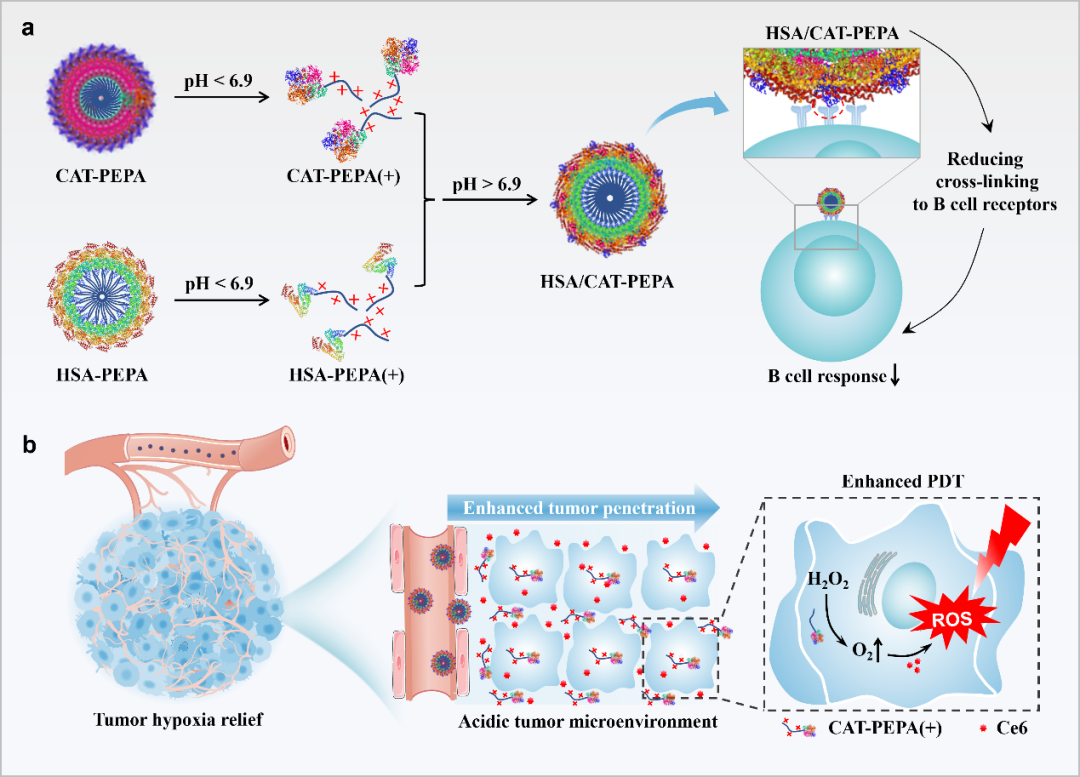
图1 HSA/CAT-PEPA共组装胶束用于减轻免疫原性、逆转肿瘤缺氧和增强氧依赖治疗。
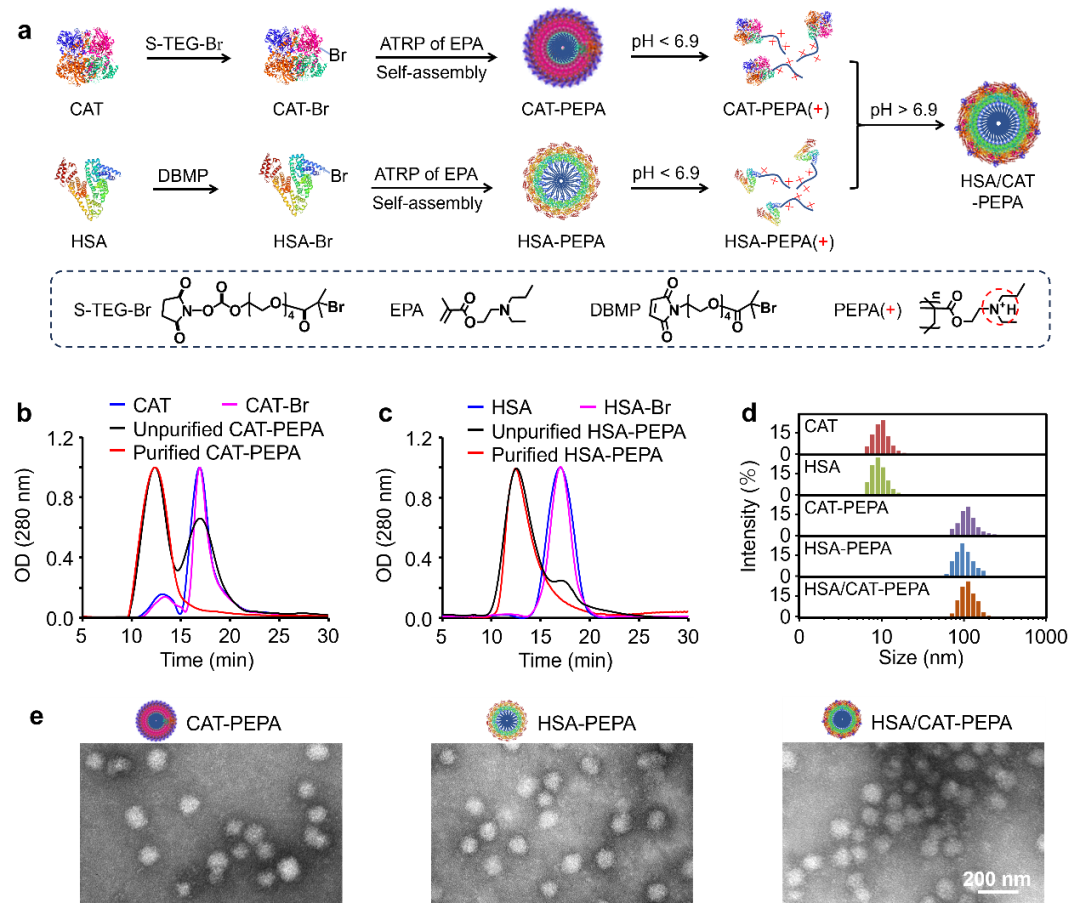
图2 HSA/CAT-PEPA共组装胶束的合成与理化表征
在该研究中,作者利用蛋白原为生长聚合物技术首先制备了酸敏白蛋白/过氧化氢酶-高分子偶联物胶束(HSA/CAT-PEPA)。电镜(TEM)和粒径(DLS)显示HSA/CAT-PEPA为尺寸~ 100 nm的均一球形(图2)。
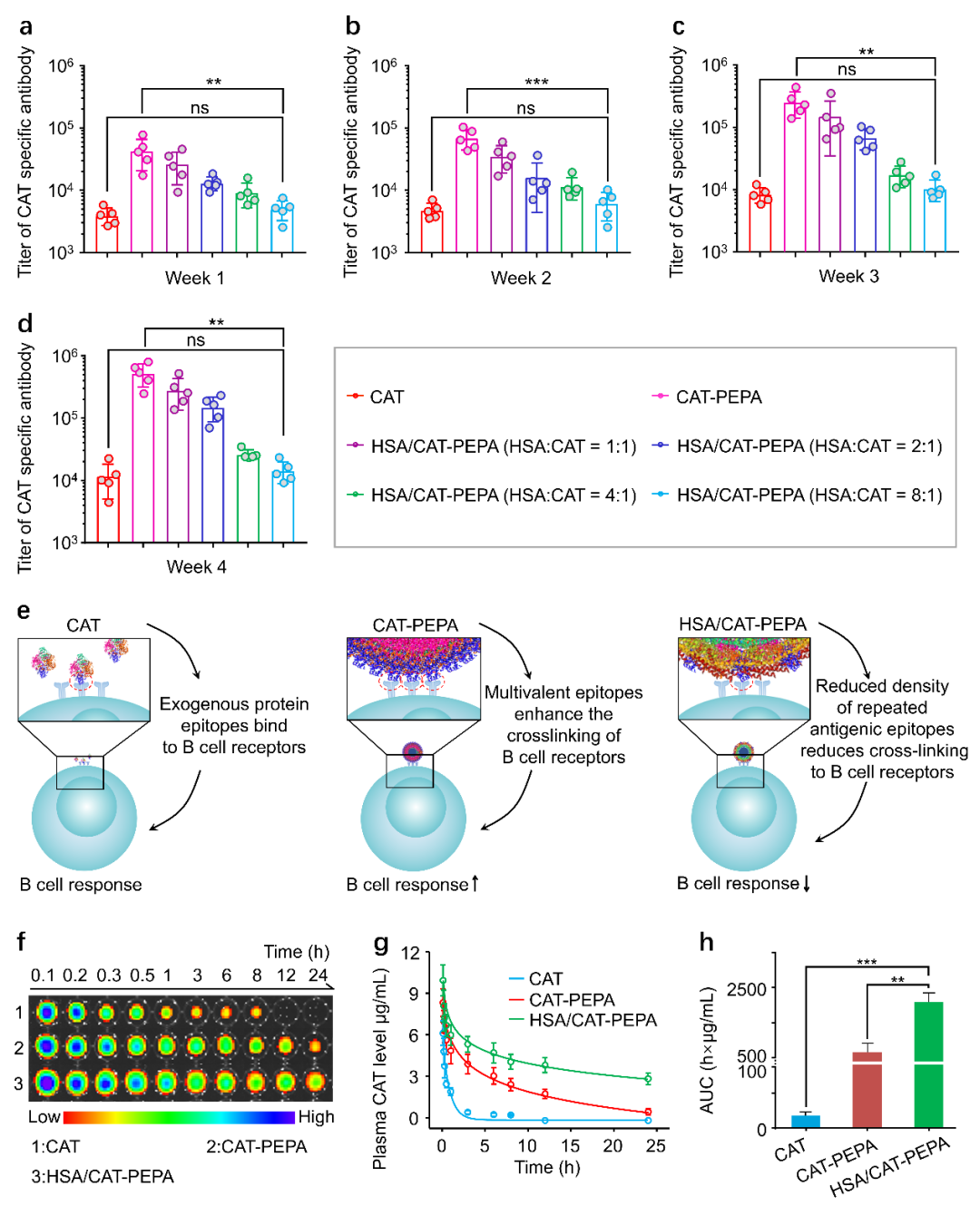
图3 HSA/CAT-PEPA纳米胶束的免疫原性研究
接着,作者证明,HSA/CAT-PEPA共组装胶束通过降低胶束表面CAT密度减少了与B细胞受体发生交联,显著降低了胶束免疫原性,从而延长了体内循环半衰期(图3)。
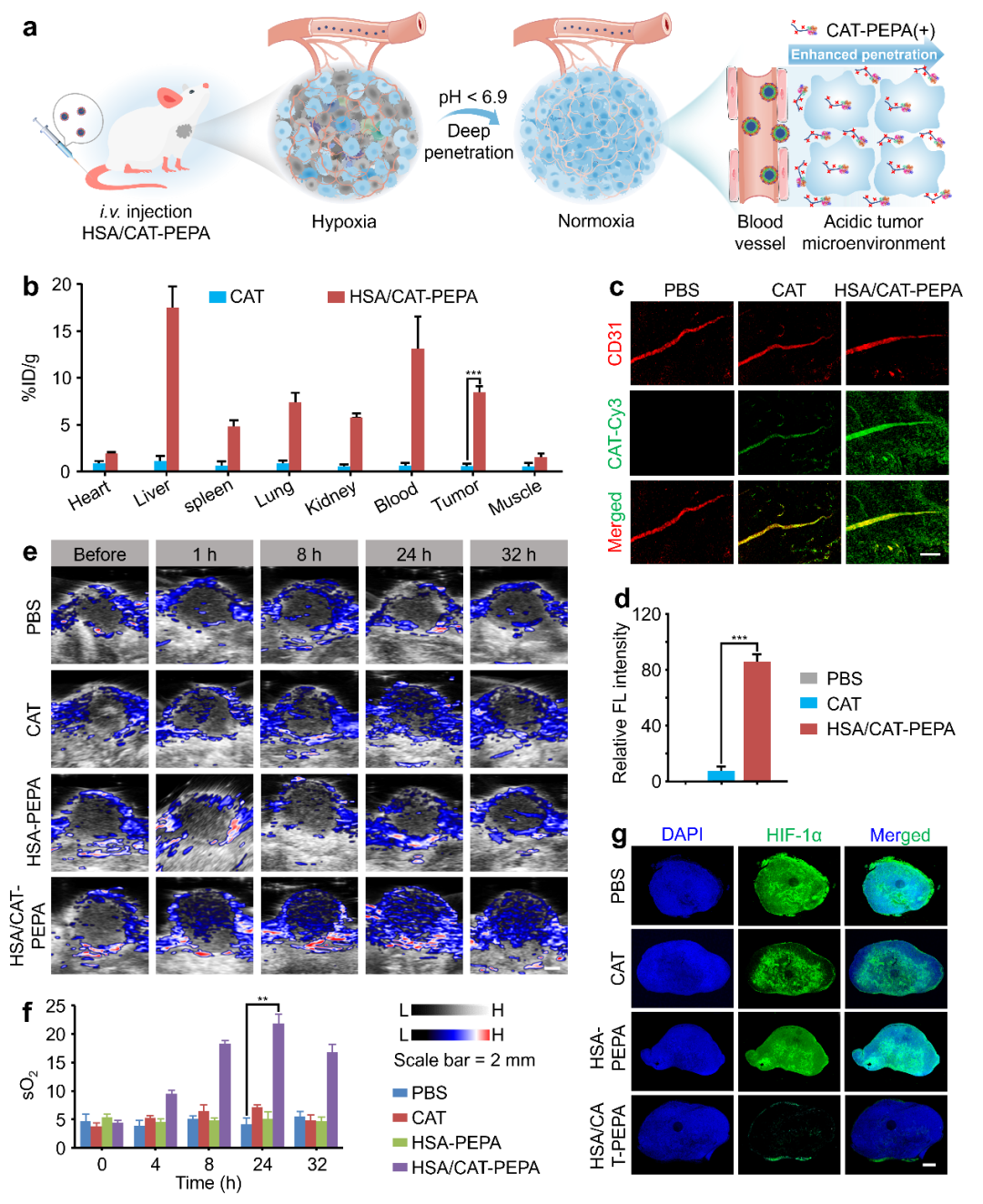
图4 HSA/CAT-PEPA的实体瘤渗透性和乏氧改善能力研究
之后,作者研究了HSA/CAT-PEPA的实体瘤渗透性和逆转肿瘤乏氧能力。由于肿瘤的微酸环境使得HSA/CAT-PEPA胶束中的超酸敏高分子PEPA(pKa = 6.9)质子化,质子化的HSA/CAT-PEPA与带负电荷的肿瘤细胞静电吸附,通过静电吸附介导的转胞吞作用促使偶联物向肿瘤深处渗透,显著提升了对实体瘤的渗透性;并且由于能有效将CAT递送到肿瘤深处,极大改善了肿瘤乏氧状况(图4)。
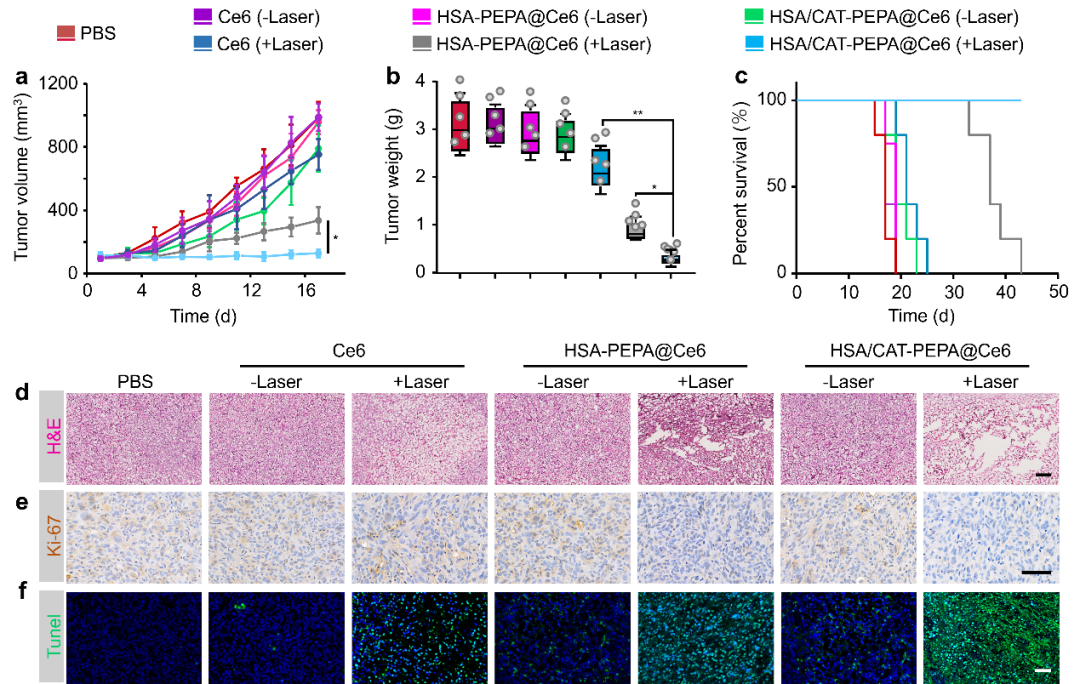
图5 HSA/CAT-PEPA@Ce6的活体PDT抗肿瘤疗效
作者最后将光敏剂Ce6包封在HSA/CAT-PEPA内形成HSA/CAT-PEPA@Ce6用于PDT抗肿瘤研究。结果显示,相比Ce6和HSA -PEPA@Ce6,HSA/CAT-PEPA@Ce6有效抑制了三阴性乳腺癌的生长,延长了小鼠的生存时间,并且显著破坏了肿瘤组织结构,表明HSA/CAT-PEPA@Ce6具有更加优异的抗肿瘤疗效(图5)。
该工作以“Hypoxia Reversion by Low-Immunogenic Ultra-Acid-Sensitive Comicelles of Protein-Polymer Conjugates Sensitizes Tumors to Photodynamic Therapy”为题发表在《J. Am. Chem. Soc》上。文章第一作者是北京大学跨学部生物医学工程系博士生黄文超。