王建六 / 战军团队揭示代谢综合征促子宫内膜癌新机制,油酸介导多胺累积开启精准治疗新方向
发布日期:2026-01-12 | 点击量:
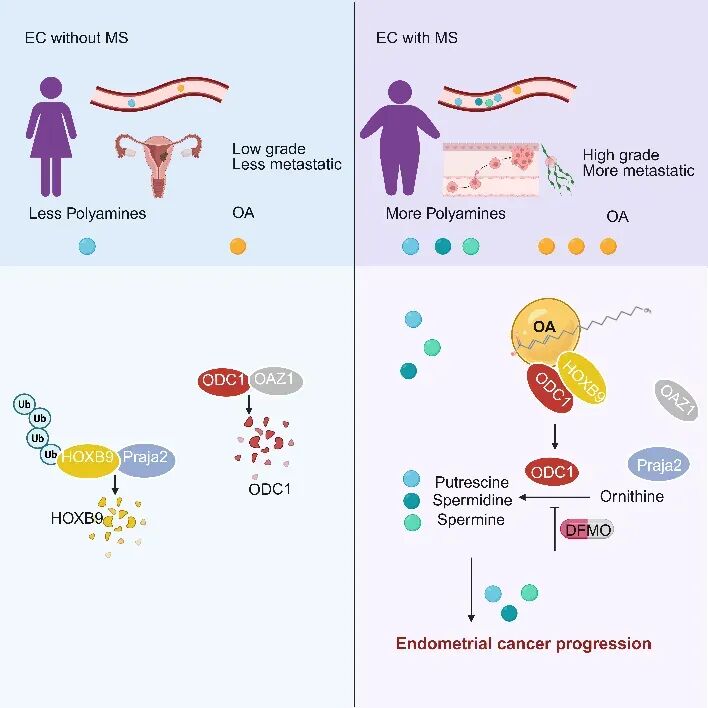
近期,北京大学人民医院王建六教授团队与北京大学战军研究员团队合作,在Nature Communications在线发表了题为 Metabolic syndrome promotes endometrial cancer by Oleic acid-mediated polyamine accumulation 的研究论文。该研究完整揭示代谢综合征通过 “油酸(OA)-HOXB9-ODC1 - 多胺轴” 驱动子宫内膜癌进展的核心分子机制,成功锁定关键治疗靶点并验证干预策略,为代谢相关子宫内膜癌的精准诊疗提供了全新科学依据和潜在解决方案。
研究背景:代谢异常与子宫内膜癌的 “致命关联” 亟待破解
子宫内膜癌(EC)是全球女性第四大常见恶性肿瘤,更是最常见的妇科恶性肿瘤。近 20 年来,其发病率持续攀升,疾病相关死亡率逐年增高,已成为严重威胁女性健康的公共卫生问题。
子宫内膜癌与肥胖的关联性远超其他肿瘤,体重指数(BMI)每增加 5 kg/m²,患病风险即升高 60%。代谢综合征(MS)作为包含糖尿病、胰岛素抵抗、肥胖、高血压、高脂血症的代谢紊乱症候群,不仅与子宫内膜癌的发生密切相关,更在肿瘤进展和不良预后中扮演关键角色。研究证实,代谢综合征患者的总生存期(OS)(HR=2.14;P=0.032)和无病生存期(DFS)(HR=1.80;P=0.045)显著更差。
然而,代谢综合征驱动子宫内膜癌进展的具体分子机制长期不明,成为制约临床精准治疗的核心瓶颈。为破解这一难题,团队率先开展临床队列研究,构建包含 62 例绝经后子宫内膜样癌患者的鉴定队列(30 例合并代谢综合征,32 例无代谢综合征)及 156 例验证队列,通过非靶向与靶向代谢组学分析发现,合并代谢综合征的子宫内膜癌患者血清多胺水平显著升高,其中腐胺与肿瘤恶性程度直接相关,可作为新型预后标志物,为机制研究锚定核心方向。
核心发现:三重机制解析 “OA-HOXB9-ODC1 - 多胺轴” 促癌密码
研究团队通过代谢组学筛查、体外细胞实验、动物模型验证及临床组织标本回溯,首次完整阐明高脂血症关键成分油酸(OA)驱动子宫内膜癌恶性进展的三重分子机制,揭示 “OA-HOXB9-ODC1 - 多胺轴” 的核心作用:
1. 分子锚定稳定:油酸锁定 HOXB9 致癌蛋白
油酸可直接与转录因子 HOXB9 蛋白结合,阻断 HOXB9 与 E3 泛素连接酶 Praja2 的相互作用,抑制 HOXB9 蛋白的泛素化降解,实现致癌蛋白的稳定性累积。表面等离子体共振(SPR)和热迁移实验进一步证实,油酸可直接结合 HOXB9 并提高其热稳定性;超分辨率显微镜观察发现,油酸诱导的脂滴与 HOXB9 多层面共定位,可能进一步增强蛋白稳定性。
2. 代谢通路激活:HOXB9 驱动多胺合成 “加速”
稳定累积的 HOXB9 蛋白与多胺合成关键酶鸟氨酸脱羧酶 1(ODC1)直接结合,竞争性抑制 ODC1 与其降解蛋白 OAZ1 的相互作用,阻止 ODC1 经蛋白酶体途径降解。实验证实,油酸以时间依赖方式显著延长 ODC1 半衰期,使 ODC1 蛋白水平升高,推动多胺合成通路持续激活,腐胺等多胺产物大量累积。
下游累积的腐胺突破传统代谢功能局限,以信号分子身份进一步抑制 HOXB9 与 Praja2 的结合,减少 HOXB9 的泛素化降解,形成 “油酸结合稳定 HOXB9-ODC1 激活产多胺 - 多胺再稳定 HOXB9” 的正反馈循环。同时发现,ODC1 与 HOXB9 存在双向正反馈调节,ODC1 可抑制 HOXB9 与 Praja2 相互作用,持续增强轴功能,显著加速肿瘤侵袭转移进程。
为确保机制的可靠性与转化价值,研究团队构建 “分子-细胞-动物-临床” 多维度验证体系,形成完整证据链:
1. 分子成像验证:脂-胺水平与肿瘤恶性程度正相关
采用拉曼光谱成像结合液相色谱 - 质谱(LC-MS)联用技术,直接证实伴代谢综合征子宫内膜癌患者肿瘤组织中油酸与多胺含量均显著升高,且总脂质及含 C-C、CH2/CH 基团的脂质含量明显增加;同时,油酸与多胺水平均与肌层浸润深度、淋巴结转移、肿瘤大小等恶性病理特征呈显著正相关。
在双侧卵巢切除高脂饮食(HFD)诱导的子宫内膜癌小鼠模型(模拟绝经后代谢综合征相关子宫内膜癌)中,使用 ODC1 特异性抑制剂 DFMO 或基因敲除 HOXB9/ODC1,可显著抑制肿瘤生长(肿瘤体积缩小),减少淋巴结转移,同时使小鼠血清和肿瘤组织中的多胺水平恢复至正常范围,证实该轴是高脂环境促癌的关键靶点。免疫组化进一步证实,敲低 HOXB9/ODC1 可降低肿瘤组织中 Ki67 的表达,减少脂滴形成。
TCGA 数据库生存分析显示,在肥胖患者(BMI 30-35)中,高 ODC1、高 HOXB9 表达均与较差的总生存期相关,且高 HOXB9 表达的肥胖患者预后显著差于正常体重患者。对 5 例化疗耐药患者原代肿瘤细胞(PTCs)进行药敏实验,证实 ODC1 抑制剂可显著提升细胞对卡铂、紫杉醇的化疗敏感性,尤其对合并高脂血症、胰岛素抵抗的复发患者效果显著,为 HOXB9、ODC1 作为治疗靶点提供直接临床依据。
本研究通过系统验证,实现四大核心创新,彻底革新代谢异常与子宫内膜癌进展的关联认知:
机制创新:首次阐明 “OA-HOXB9-ODC1 - 多胺轴” 的驱动作用,明确该轴是代谢综合征促进子宫内膜癌进展的核心分子机制,填补了代谢综合征与肿瘤多胺代谢调控关联的研究空白,为解析代谢异常与肿瘤恶性表型的关联提供首个明确的脂-信号-代谢交叉通路。
标志物创新:确立多胺的血清预后标志物价值,通过 “鉴定队列-验证队列” 双重临床样本验证,证实血清 / 组织多胺水平与肿瘤不良病理特征直接相关,为子宫内膜癌无创预后评估提供全新靶点,助力高危人群分层管理。
代谢关联创新:建立脂代谢与多胺代谢的全新联系,在 11 种常见脂肪酸中精准锁定油酸是驱动多胺累积的核心因子,首次打通高脂血症关键成分(脂代谢核心分子)与多胺合成(氨基酸分解代谢核心通路)的调控链条,揭示代谢综合征促癌的 “脂 - 胺转化” 关键环节。
分子功能创新:拓展多胺与 HOXB9 的功能边界,发现多胺除传统代谢功能外,可作为信号分子参与正反馈调控;同时明确 HOXB9 除转录调控外,可作为肿瘤脂肪酸代谢的 “分子感受器”,直接结合油酸并介导下游信号激活,突破了 HOXB9 仅作为转录因子调控肿瘤进展的传统认知,丰富了转录因子的非转录功能认知。
临床价值:构建 “诊断-治疗-耐药逆转” 全链条解决方案
该研究成果形成三重临床转化价值,为子宫内膜癌精准诊疗提供可行路径:
诊断革新:血清多胺检测作为无创标志物,可实现合并代谢综合征子宫内膜癌患者预后的动态监测,为高危人群分层管理提供客观依据,助力精准筛查与预后评估。
治疗突破:ODC1 作为已获批临床使用的靶点(用于治疗罕见病),其抑制剂 DFMO 的再利用可快速推进临床转化。动物实验已证实其对高脂相关子宫内膜癌的靶向治疗效果,为 “老药新用” 提供新方向,也拓展了王建六教授团队此前提出的 “一抗三降” 代谢干预策略的靶点范围。
耐药逆转:ODC1 抑制剂与化疗药物的协同作用,可逆转化疗耐药患者 PTCs 的敏感性,为晚期复发耐药患者提供全新联合治疗方案,有望改善这类患者的不良预后。
该研究不仅破解了代谢综合征促发子宫内膜癌的核心机制,更开创了 “代谢调控 + 靶向治疗” 的精准医学新范式。目前,王建六教授团队已启动两项临床研究:一是评估血清多胺作为子宫内膜癌预后标志物的前瞻性验证研究,二是 ODC1 抑制剂联合一线化疗治疗肥胖相关进展期子宫内膜癌的安全性与有效性临床研究。
随着研究推进,未来有望通过监测血清多胺水平制定个性化饮食干预方案(如控制油酸摄入),结合 ODC1 靶向药物实现 “预防 - 治疗 - 预后监测” 的全链条管理,为肥胖相关恶性肿瘤的防治带来革命性突破。
全文链接:https://doi.org/10.1038/s41467-025-67083-y