乏氧是实体瘤微环境的一大特征,肿瘤血管异常,肿瘤细胞的快速增殖,使得血管中的氧供低于细胞增殖的氧气消耗。乏氧与肿瘤的异常增殖,侵袭和转移,治疗抵抗高度相关。然而,乏氧也为肿瘤靶向治疗提供了潜在机会。
近期,北京大学跨学部生物医学工程系高卫平教授课题组通过定点原位聚合技术合成了具有乏氧响应性的蛋白质-高分子偶联物干扰素-聚氮氧化物(IFN-PODMA)(图1 a), IFN-PODMA可以被肿瘤乏氧区域高表达的CYP450酶还原为IFN-PDMA,肿瘤的微酸环境使得IFN-PDMA质子化,质子化的IFN-PDMA与带负电荷的肿瘤细胞静电吸附,通过静电吸附介导的转胞吞作用促使偶联物向肿瘤深处渗透(图1b)。静脉注射后,IFN-PODMA在肿瘤组织中的保留与临床使用的长效干扰素PEGASYS类似,但远高于IFN(图2a)。IFN-PODMA对体内肿瘤和3D肿瘤细胞球(MTSs)的渗透性远高于PEGASYS和IFN(图2b,c)。同时,IFN-PODMA对黑色素瘤小鼠的抗肿瘤效果和对肿瘤组织细胞的杀伤性远高于PEGASYS和IFN(图 3)。这项工作首次揭示了药物-聚氮氧化物偶联物向肿瘤乏氧区域渗透的机制。
该工作以“Hypoxia-Triggered Bioreduction of Poly(Noxide)−Drug Conjugates Enhances Tumor Penetration and Antitumor Efficacy”为题发表在《J. Am. Chem. Soc》上。文章第一作者是北京大学未来技术学院博士生张龙帅。该研究得到国家自然科学基金委的支持。
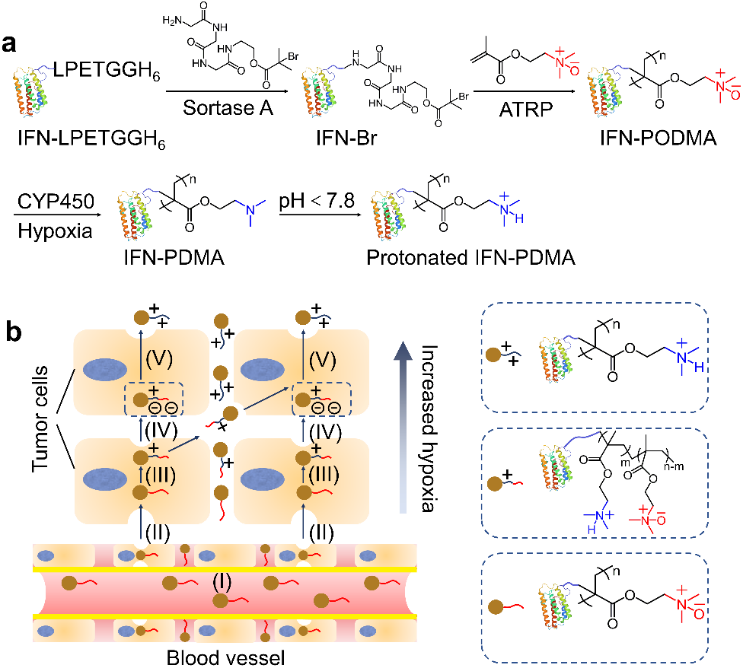
图1 (a) Sortase A酶介导的蛋白质连接和通过原子转移自由基聚合(ATRP)在IFN的C端原位生长IFN-PODMA偶联物;乏氧条件下,CYP450酶催化IFN-PODMA还原为IFN-PDMA;PDMA在酸性条件下进一步质子化。(b) IFN-PODMA可以在体内长循环(I);一旦它进入肿瘤(II);在肿瘤的乏氧区域被CYP450酶还原为IFN-PDMA(III);质子化的IFN-PDMA通过静电吸附作用(IV)与带负电荷的肿瘤细胞通过静电吸附介导的转胞吞作用(V),促使偶联物向肿瘤深处渗透。
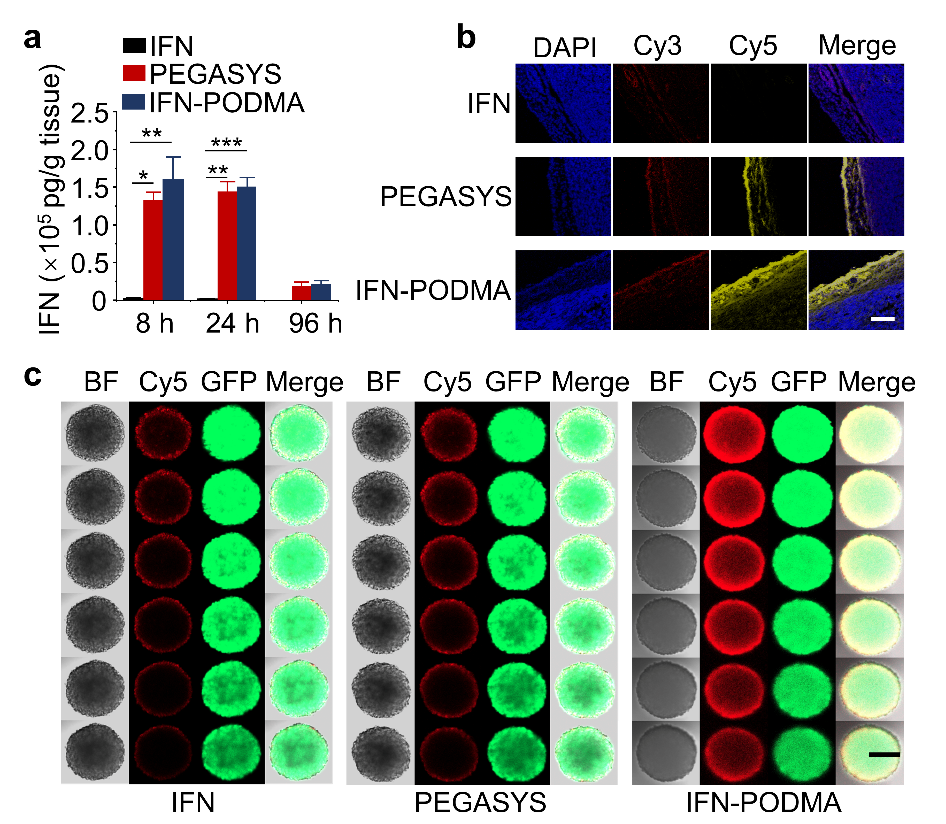
图2. (a) 静脉注射IFN类似物后,在特定时间点的肿瘤中IFN的浓度。(b) 在体内肿瘤中IFN类似物的渗透性。(c) 乏氧条件下,Cy5标记的IFN类似物对C8161肿瘤细胞球(3D MTSs)的渗透情况。
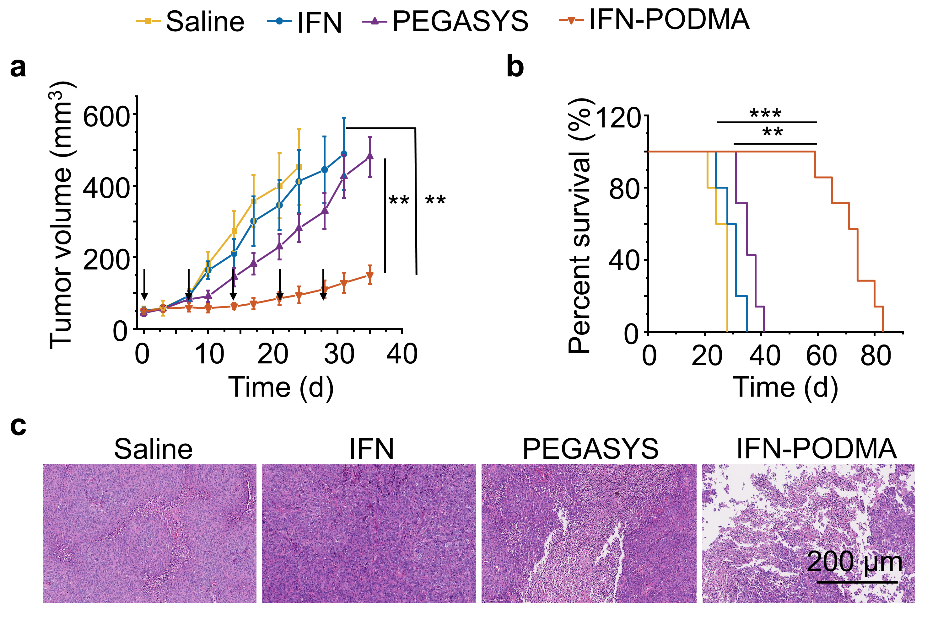
图3. IFN-PODMA在黑色素瘤小鼠模型中的抗肿瘤活性。(a)小鼠肿瘤生长曲线。(b) 小鼠的生存曲线。(c) 治疗后的肿瘤组织的H&E染色。
原文链接:
https://pubs.acs.org/doi/pdf/10.1021/jacs.2c10188